Labormedizin und Mikrobiologie für die Gastroenterologie
Die Labormedizin und die Mikrobiologie leisten einen wertvollen Beitrag zur Diagnostik in der Gastroenterologie. Auf dieser Seite informieren wir über die wichtigsten Parameter und ihre Bedeutung zum Beispiel in der Krebsvorsorge.
Mikrobiom im Darm
Der Darm ist neben der Leber das aktivste Stoffwechselkompartiment des Organismus. Die Vielfalt des Darm-Mikrobioms mit mehr als 500 verschiedenen Spezies sowie hohen Keimkonzentrationen mit ca.1012 Bakterien pro Gramm Stuhl besteht nicht von Geburt an, sondern baut sich im Laufe der Individualentwicklung auf. Schon kurze Zeit nach der Geburt kommt es auf natürlichem Wege durch Geburt und Stillen zur Besiedelung mit Laktobazillen und Bifidobakterien, die eine dauerhafte Besiedelung mit Anaerobiern einleiten, die beim Erwachsenen ca. 99 % der Darmflora ausmachen. Insgesamt trägt dieses gesunde Darmmikrobiom entscheidend dazu bei, dass sich pathogene Keime nur schwer an den Darmepithelzellen anlagern können. Weitere wichtige Funktionen der Intestinalflora sind die Unterstützung der Verdauung durch die Erweiterung der enzymatischen Kapazität, die Stimulation der Darmperistaltik, eine Beteiligung an der Vitaminsynthese und die Regulation der Entwicklung und Funktion des darmassoziierten Immunsystems.
Störungen der Intestinalflora werden mit einigen Darmerkrankungen und allergischen Erkrankungen des atopischen Formenkreises in Zusammenhang gebracht. Wird das Gleichgewicht zwischen protektiven und potenziell pathogenen Spezies gestört, kann es zur Überwucherung mit proteolytischen Keimen (z. B. Bakterienarten der Gattungen Klebsiella, Proteus, Clostridioides) sowie zur Vermehrung von Hefen wie Candida albicans kommen. Dies kann zur Schädigung der Darmmukosa führen. Zu den Symptomen, die dabei auftreten können, zählen Abdominalschmerzen, Diarrhoe, Meteorismus, Infektanfälligkeit und chronische Müdigkeit.
Physiologische Zusammensetzung der Darmflora
Die gesunde Darmflora setzt sich überwiegend aus anaeroben und mikroaerophilen Keimen zusammen. Aerobe Keime machen nur ca. ein Prozent der Gesamtbesiedelung aus. Dabei unterscheidet sich die Zusammensetzung der Gastrointestinalflora qualitativ und quantitativ in den verschiedenen Kompartimenten des Gastrointestinaltrakts.
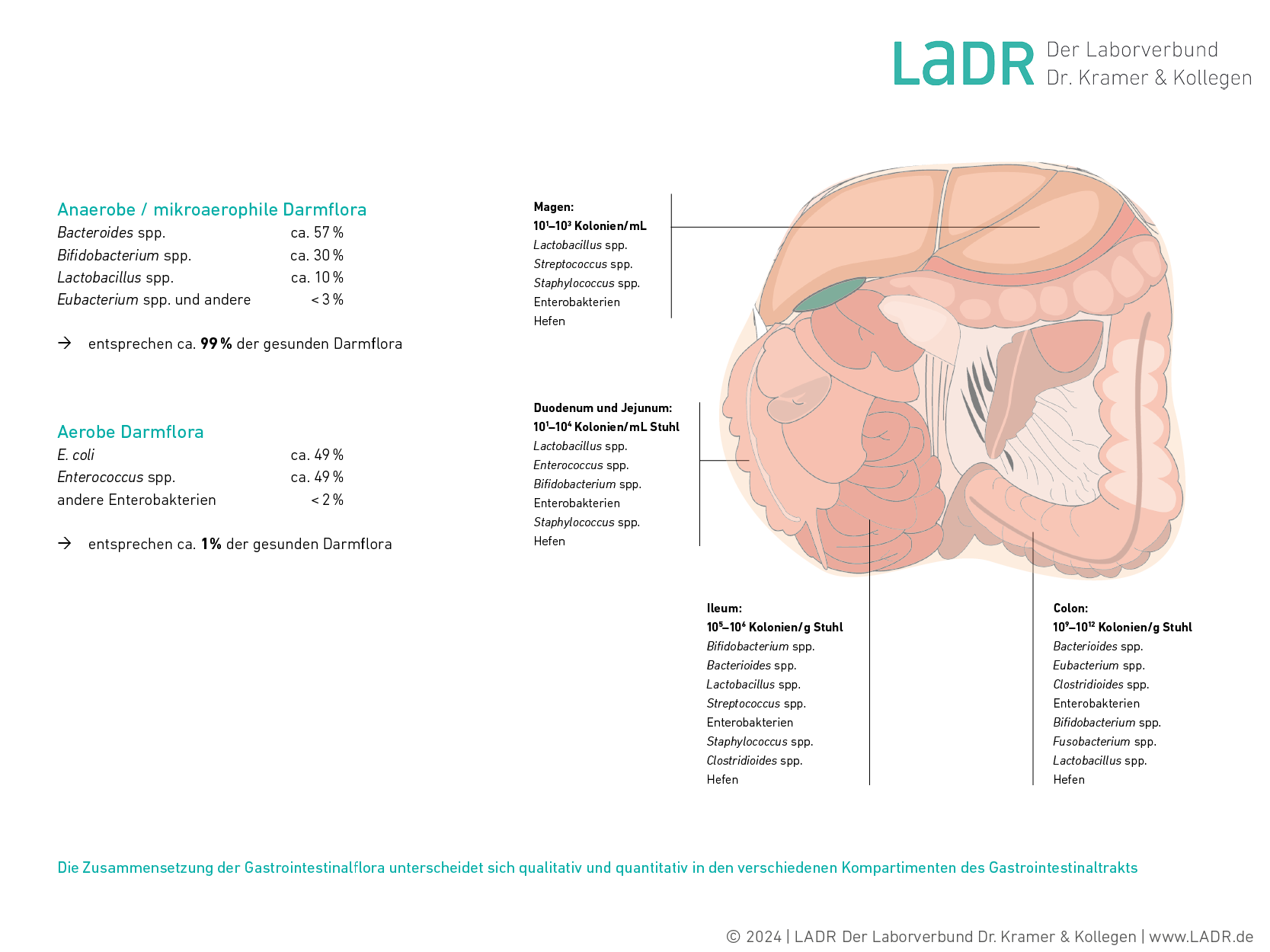

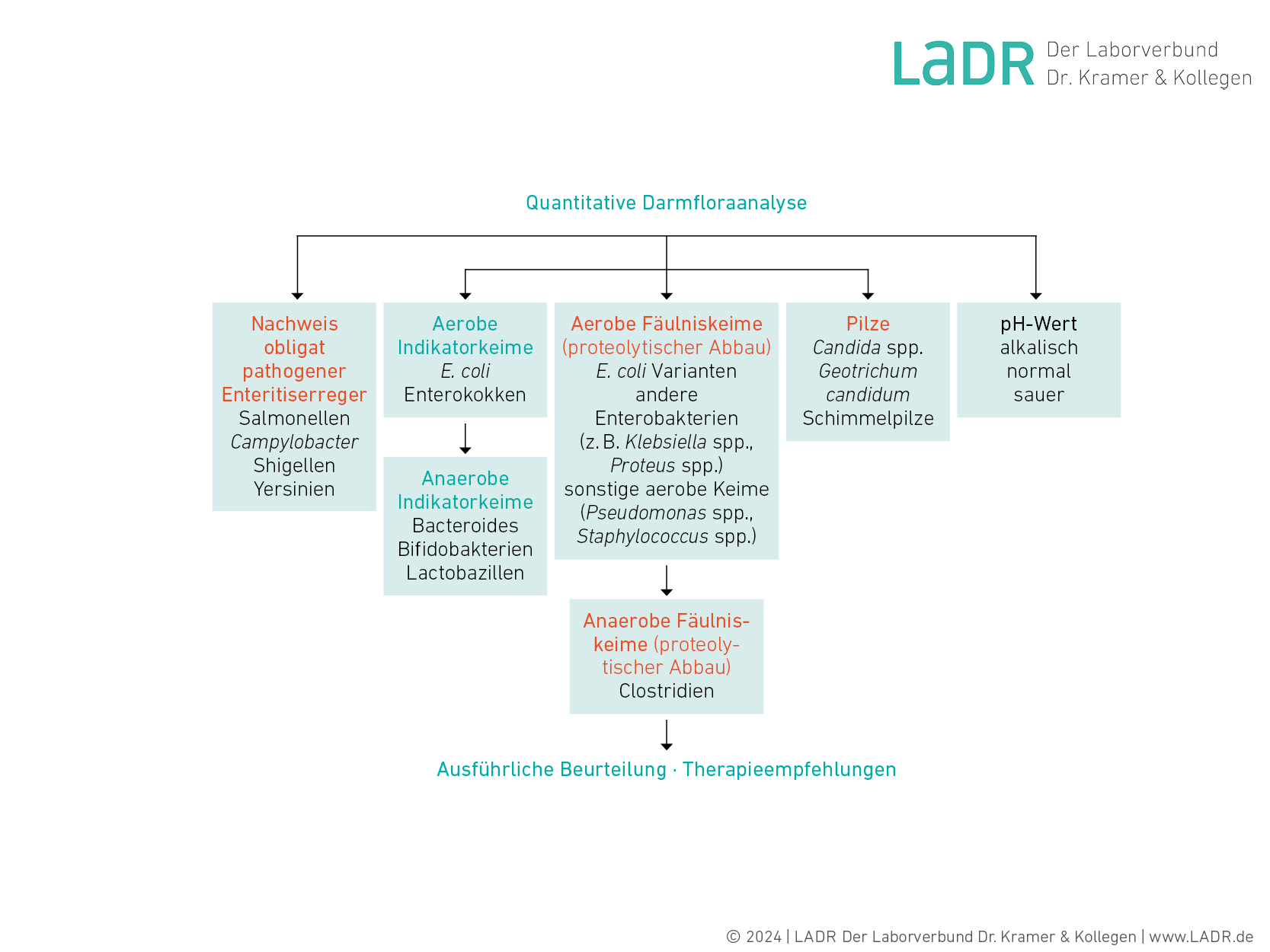
Quantitative Darmfloraanalyse und Stuhldiagnostik
Die quantitative Darmfloraanalyse liefert vielfach wichtige Hinweise auf die Ursachen funktioneller Abdominalbeschwerden. Neben der qualitativen Untersuchung des Stuhls auf obligat pathogene Erreger (Salmonellen, Campylobacter, Yersinien, Shigellen) und der Bestimmung des pH-Wertes umfasst die quantitative Darmfloraanalyse die Keimzahlbestimmung von aeroben und anaeroben Indikatorkeimen (Protektivflora), Keimen mit ausgeprägtem proteolytischem Stoffwechsel und Pilzen (siehe Fließdiagramm). Anhand der ermittelten Ergebnisse erfolgt eine ausführliche schriftliche Befundung und Bewertung der Keimzusammensetzung. Soweit möglich, werden auch Therapieempfehlungen gegeben.

Norm- und Toleranzbereiche der Parameter
| Keimzahlen der aeroben Indikatorflora | |
|---|---|
| Toleranzbereich [kbE/g Stuhl] | |
| E. coli | 105–108 |
| E. coli Varianten | < 105 |
| andere Enterobakterien | < 105 |
| sonstige Aerobier | < 104 |
| Keimzahlen der anaeroben Indikatorflora | |
|---|---|
| Toleranzbereich [kbE/g Stuhl] | |
| Bacteroides spp. | 108–1010 |
| Bifidobacterium spp. | 108–1010 |
| Clostridioides spp. | < 106 |
| Lactobacillus spp. (mikroaerophil) | 105–108 |
| Keimzahlen der Pilze | |
|---|---|
| Toleranzbereich [kbE/g Stuhl] | |
| Candida albicans | < 103 |
| Candida spp. | < 103 |
| Geotrichum spp. | < 5 × 102 |
| Schimmelpilze | negativ |
| pH-Wert | |
|---|---|
| Toleranzbereich [kbE/g Stuhl] | |
| pH-Wert | 5,8–7,2 |
Die wichtigsten quantitativen Stuhlparameter und deren Indikationen
| Calprotectin | Diagnostik und Verlaufskontrolle der chronisch-entzündlichen Darmerkrankungen (CED), Ausschluss von Reizdarmsyndrom |
| Lactoferrin | Diagnostik und Verlaufskontrolle der chronisch-entzündlichen Darmerkrankungen (CED), Ausschluss von Reizdarmsyndrom, Ausschluss der Darminfektionen |
| Sekretorisches Immunglobulin A | Diagnostik von sIgA-Mangel (bei rezidivierenden Infektionen und Erkrankungen des allergischen Formenkreises) |
| Tumor M2-Pyruvatkinase | Diagnostik von gastrointestinalen Tumoren |
| Hämoglobin (okkultes Blut) | Diagnostik von gastrointestinalen Tumoren, Blutungen |
| α1-Antitrypsin | Diagnostik und Verlaufskontrolle des intestinalen Proteinverlustes |
| Pankreatische Elastase 1 | Marker für exokrine Pankreasinsuffizienz |
| Quantitative Stuhlfettanalyse | Nachweis einer Steatorrhoe bei Verdacht auf Malabsorbtion oder Maldigestion |
| Beta-Carotin (im Serum) | Indirekter Nachweis einer Steatorrhoe |
| Gallensäuren | Diagnostik des Gallensäuren-Verlustsyndroms |
| Zonulin | Leaky-Gut-Syndrom bei Autoimmunerkrankungen oder allergischen Erkrankungen |
Calprotectin im Stuhl
Calprotectin ist ein Calcium-bindendes Protein, welches vorwiegend aus neutrophilen Granulozyten und Monozyten bei Stimulation (Entzündung) freigesetzt und im Stuhl ausgeschieden wird. Die Calprotectin-Konzentration im Stuhl korreliert mit der Anzahl der eingewanderten Leukozyten und mit dem Ausmaß der entzündlichen Reaktion im Darm. Eine Differenzierung verschiedener Ursachen der Entzündung, insbesondere zwischen chronisch entzündlichen Darmerkrankungen (CED) und infektiösen Diarrhöen, ist nicht möglich. Fäkales Calprotectin stellt einen geeigneten Marker zur Bestimmung der Entzündungsaktivität bei chronisch entzündlichen Darmerkrankungen (Morbus Crohn, Colitis ulcerosa, kollagene Colitis) dar. Die Calprotectin-Werte normalisieren sich dabei bei endoskopischer Abheilung. Eine diagnostische Bedeutung wird auch der Prognose von Schüben der CED zugeschrieben.
Der Stellenwert der Calprotectin-Bestimmung liegt insbesondere in der Differenzierung der CED und funktionellen Beschwerden/Reizdarmsyndrom (bei einem Grenzwert von 50 mg/kg für Erwachsene: Sensitivität 93 %, Spezifität 96 % und für Kinder: Sensitivität 92 %, Spezifität 76 %).
Geringgradig (1,5-fach) erhöhte Calprotectin-Werte werden bei Barrett-Ösophagus, Ulkus ventriculi, Gastritis/Duodenitis detektiert. Mittelgradige (10–15-fache) Erhöhung kann bei Magenkarzinom und kolorektalem Karzinom beobachtet werden. Hochgradig (10–30-fach) erhöhte Werte können bei Morbus Crohn und Colitis ulcerosa bestimmt werden.
Wegen begrenzter Spezifität ist der Test zum Screening für kolorektale Karzinome nur bedingt geeignet. In Stuhlproben ist Calprotectin über einige Tage bei Raumtemperatur stabil. Das Einfrieren von Stuhlproben kann durch Freisetzung aus zerstörten Leukozyten zur Erhöhung von Calprotectin-Werten führen.
Lactoferrin im Stuhl
Lactoferrin ist ein Eisen bindendes Glykoprotein aus polymorphkernigen Neutrophilen. Monozyten und Lymphozyten bilden kein Lactoferrin. Die fäkale Lactoferrin-Konzentration korreliert mit der Infiltration der intestinalen Schleimhaut durch Granulozyten und stellt ähnlich wie das Calprotectin einen Marker für einen zellulären entzündlichen Prozess im Darm dar.Lactoferrin weist keine Spezifität bezüglich der zugrunde liegenden Erkrankung auf, sondern zeigt generell das Vorhandensein und das Ausmaß der Entzündung im Darm an wie bei Infektionen, CED, Diverticulitis u. a.
Die Lactoferrin-Bestimmung hat einen hohen Stellenwert bei der Differenzierung zwischen entzündlichen Erkrankungen und dem Reizdarmsyndrom (Sensitivität 86 %, Spezifität 99 %). Die Sensitivität zur Erkennung der Entzündungsaktivität bei CED beträgt ca. 90 %, es wurde ein negativer prädiktiver Wert von 99 % ermittelt. Lactoferrin ist stabil im Stuhl für mindestens 5 Tage bei Raumtemperatur.
Sekretorisches Immunglobulin A im Stuhl
Das sekretorische Immunglobulin A (sIgA) wird von den Plasmazellen in den Schleimhäuten des Gastrointestinal-, Urogenital-und Respirationstrakts sowie in Tränen-, Speichel-, Brustdrüsen gebildet und in die Sekrete sezerniert. Das sIgA besteht aus zwei IgA-Monomeren, verbunden durch eine J-Kette sowie einer sekretorischen Komponente, die vor dem Abbau durch Proteasen schützt. Die sekretorische Komponente wird von den Epithelzellen gebildet und bindet nachträglich an das IgA. Säuglinge werden über die Muttermilch mit sIgA versorgt. Die Funktion des sIgA ist die Bindung von Toxinen, Mikroorganismen, Nahrungsmittelantigenen.
Ein sIgA-Mangel ist häufiger mit rezidivierenden Infektionen und Erkrankungen des allergischen Formenkreises assoziiert. Die Produktion des sIgA kann bei humoralen Immundefekten bzw. Immunsupression vermindert sein. In wässrigen
Stuhlproben (durch Verdünnung) können falsch niedrige Werte bestimmt werden.Erhöhte sIgA-Werte können auf ein entzündliches Geschehen im Gastrointestinaltrakt hinweisen.
Tumor M2-Pyruvatkinase im Stuhl
Pyruvatkinase (PK) ist ein im Zellstoffwechsel unentbehrliches Enzym, welches bei der Glykolyse gewonnene Energie als ATP bereitstellt und eine wichtige Rolle bei der Zellproliferation spielt. Es sind vier gewebsspezifische Isoformen der PK bekannt. Während der Karzinogenese verändert sich das Isoenzymmuster: Die dimere Form (M2-PK) wird überexprimiert. M2-PK ist kein organspezifischer Tumormarker. Erhöhte M2-PK-Werte im Plasma werden bei verschiedenen Neoplasien beobachtet: Nierenzell-, Bronchial-, Pankreaskarzinom. Im Stuhl finden sich erhöhte Konzentrationen von M2-PK bei gastrointestinalen Tumoren wie z. B. bei kolorektalem Karzinom. M2-PK wird aber nicht nur bei Darmkrebs freigesetzt: Patient*innen mit chronisch-entzündlichen Darmerkrankungen, Pouchitis oder Divertikulitis weisen ebenfalls erhöhte Werte auf. Als Vorteil dieses Tests wird die Möglichkeit des Nachweises von nicht blutenden Tumoren aufgeführt.
Die Sensitivität bei Kolonkarzinom beträgt 80–85 %, die Spezifität 70–80 %. Die Sensitivität bei Rektumkarzinomen und Adenomen ist niedriger (44 % bei Adenomen > 1 cm). Bei positivem Nachweis sollten weiterführende Untersuchungen (z. B. Koloskopie, Gastroskopie) durchgeführt werden.
Für den Tumor M2-PK-Stuhltest liegen keine randomisierten kontrollierten Screeningstudien vor. M2-PK ist stabil im Stuhl für 2 Tage bei Raumtemperatur.
FOBT (Fecal Occult Blood Test) – Blut im Stuhl
Makroskopisch nicht erkennbares (okkultes) Blut im Stuhl kann bei zahlreichen pathologischen Prozessen des Gastrointestinaltraktes (u. a. Oesophagusvarizen, Magenulkus, Duodenalulkus, Tumore, entzündliche Darmerkrankungen,
Divertikulitis, Hämorrhoiden) nachweisbar sein. Die Bestimmung kann im Rahmen der Vorsorgeuntersuchungen zur Früherkennung von Darmkrebs oder zum Nachweis gastrointestinaler Blutungen erfolgen.
Bisher waren guajakbasierte chemische Stuhltests (gFOBT) gebräuchlich. Die Sensitivität der gFOBTs ist gering. Diese Tests basieren auf der Pseudoperoxidaseaktivität von Hämoglobin und sind daher nicht spezifisch für humanes Hämoglobin. Nahrungsmittelbestandsteile wie tierisches Blut oder einige pflanzliche Stoffe können die Ergebnisse verfälschen. Die Auswertung der Ergebnisse ist subjektiv und nicht automatisierbar.
Die immunologischen Tests (iFOBT oder FIT – Fecal Immunochemical Tests) sind den gFOBT überlegen und zeichnen sich durch deutlich bessere analytische Eigenschaften im Hinblick auf Sensitivität aus. Generell unterscheidet man zwischen qualitativen Schnelltests und quantitativen iFOBT. Die EU-Leitlinie zur Darmkrebsprävention empfiehlt quantitative immunologische FOBT als Methode der Wahl.
Ein positiver Nachweis von okkultem Blut im Stuhl indiziert eine weiterführende Diagnostik wie z. B. eine Endoskopie.
α1-Antitrypsin im Stuhl
α1-Antitrypsin (α1-AT) gehört zur Familie der Serinprotease-Inhibitoren, die Proteasen wie Elastase, Trypsin, Chymotrypsin durch die Komplexbildung irreversibel hemmen. α1-AT wird hauptsächlich in Hepatozyten bzw. in Makrophagen und Monozyten synthetisiert. Da α1-AT im Darm weder einer intestinalen Degradation noch Resorption unterliegt, erscheint es besonders geeignet zur Diagnostik und Verlaufskontrolle des intestinalen Proteinverlustes. Enterale Eiweißverluste infolge einer erhöhten Schleimhautpermeabilität können unterschiedlicher Genese sein: u. a. Morbus Crohn, einheimische Sprue, Morbus Whipple, chronische mesenteriale Ischämie, Blind-loop-Syndrom, nekrotisierende Enterokolitis, erworbene Lymphabflussstörungen, intestinales Lymphom, systemischer Lupus erythematodes, Darmtuberkulose. Da α1-AT bei pH-Werten < 3 im Magensaft nicht stabil ist, lässt sich der verstärkte gastrale Eiweißverlust
bei Morbus Menetrier durch Bestimmung des intestinalen α1-AT nicht so zuverlässig nachweisen.
Erhöhte Werte von fäkalem α1-AT können auch bei intestinalen Blutungen nachgewiesen werden.
α1-AT ist ein Akute-Phase-Protein, deshalb können die Serum-Spiegel von α1-AT erheblichen Schwankungen unterliegen. Die Bestimmung der α1-AT-Clearance ist der einzelnen Testung von α1-AT im Stuhl überlegen und erhöht die Sensitivität der Untersuchung. Die α1-AT-Clearance kann aus der α1-AT-Serum- und -Stuhlkonzentration sowie der Stuhlmenge (von 3 aufeinanderfolgenden Tagen) berechnet werden. Die Ergebnisse der α1-AT-Clearance-Bestimmung korrelieren gut mit nuklearmedizinischen diagnostischen Methoden der exsudativen Enteropathie. α-1-Antitrypsin ist stabil im Stuhl über mindestens 7 Tage bei Raumtemperatur.
Pankreatische Elastase (PE) 1 im Stuhl
Pankreatische Elastase wird in Azinuszellen des Pankreas als Proenzym gebildet und wird im Intestinallumen durch Trypsin aktiviert. Die PE spaltet Elastin, nicht aber Kollagen und Keratin. Die Sekretion von PE korreliert mit der Bildung von weiteren Pankreas-Enzymen wie Lipase, Amylase und Trypsin. Während der Darmpassage erfolgt im Gegensatz zu Chymotrypsin nur ein geringer Abbau; die Konzentration von PE im Stuhl ist deshalb um Faktor 5–6 höher als im Duodenalsekret.
Die Reduktion der fäkalen PE-Ausscheidung korreliert mit der exkretorischen Pankreasinsuffizienz. Bei einem Grenzwert von 200 μg/g Stuhl beträgt die Sensitivität 93 %, Spezifität 93 %. Die Vergleichswerte für Chymotrypsin betragen 65 % Sensitivität und 90 % Spezifität. Vor allem geringgradige Funktionseinschränkungen der exokrinen Pankreasfunktion werden durch Bestimmung von PE im Vergleich zu Chymotrypsin besser erfasst. Die Abnahme der PE im Stuhl ist ein sensitiver Marker für die exkretorische Pankreasinsuffizienz bei Patient*innen mit zystischer Fibrose.
Die Substitutionstherapie beeinflusst die Bestimmung von PE nicht. In wässrigen Stuhlproben können falsch-pathologische Werte bestimmt werden. In Stuhlproben ist die PE über 5 Tage bei Raumtemperatur stabil.
Quantitative Stuhlfettanalyse
Die Bestimmung der 24 h-Stuhlfettausscheidung kann als Screening-Test zum Nachweis einer Steatorrhoe bei Verdacht auf Malabsorbtion oder Maldigestion durchgeführt werden. Die Stuhlfett-Konzentration hat einen geringen diagnostischen Wert. Die mikroskopische Fettbestimmung ist obsolet.
Die normale tägliche Stuhlausscheidung ist relativ konstant und ist von der Nahrungsaufnahme unabhängig (ca. 3 g pro Tag). Zur Steatorrhoe können zahlreiche Erkrankungen führen. Die Malabsorbtion (Einschränkung der Absorptionsfähigkeit des Dünndarms) entsteht bei endemischer und tropischer Sprue, intestinalen Lymphomen, Amyloidose, Morbus Crohn, Morbus Whipple u. a. Die Steatorrhoe im Rahmen einer Maldigestion kann bei exkretorischer Pankreasinsuffizienz (chronische Pankreatitis, Resektion, Tumoren), Störungen des Gallensäurestoffwechsels (Leberinsuffizienz, Gallengangobstruktion, mikrobielle Dekonjugation bei Überwucherung des Dünndarms, Unterbrechung des enterohepatischen Kreislaufs bei z. B. Ileumresektion) auftreten.
Die Stuhlfettausscheidung ist wegen großer Funktionsreserve des Pankreas zur Frühdiagnostik der exokrinen Pankreasinsuffizienz eher bedingt geeignet.
Die quantitative Stuhlfettanalyse setzt eine konstante orale Aufnahme von 80–100 g Neutralfett drei Tage vor und während der Sammelperiode voraus. Es wird eine Sammelperiode von 3–4 aufeinanderfolgenden Tagen mit Konservierung des Materials bei 4 °C empfohlen. Eine Kontamination mit Urin ist unbedingt zu vermeiden.
Beta-Carotin im Serum
Die Steatorrhoe kann indirekt über die Bestimmung von Beta-Carotin (β-Carotin) im Serum erfasst werden. Die Untersuchung stellt eine sehr gute Alternative zur Stuhlfettanalyse und der damit verbundenen, wenig praktikablen Stuhlsammlung über mehrere Tage dar. Das β-Carotin – fettlösliches Provitamin A – korreliert reziprok mit der Fettausscheidung im Stuhl. Da β-Carotin in geringem Maße gespeichert werden kann, tritt bei einer Fett-Malassimilation eine Verminderung der Serum-Werte schon nach wenigen Wochen ein. Der Test erlaubt keine Aussage über das Ausmaß der Steatorrhoe und lässt keine Rückschlüsse zu auf die Ursachen der Fett-Malassimilation. Da Carotine im gelben und grünen Gemüse enthalten sind, sollte übermäßige Aufnahme solcher pflanzlicher Produkte vor Probenentnahme vermieden werden. Potentielle Störfaktoren sind Carotin-Mangelernährung (Alkohol-Abusus), Fieber, Lebererkrankungen.
β-Carotin-Konzentrationen > 1000 μg/l schließen eine Steatorrhoe weitgehend aus. β-Carotin-Werte < 470 μg/l deuten auf eine erhöhte Stuhlfettausscheidung hin. Die Serum-Proben (nüchtern) sollten lichtgeschützt in Alufolie transportiert und aufbewahrt werden.
Gallensäuren im Stuhl
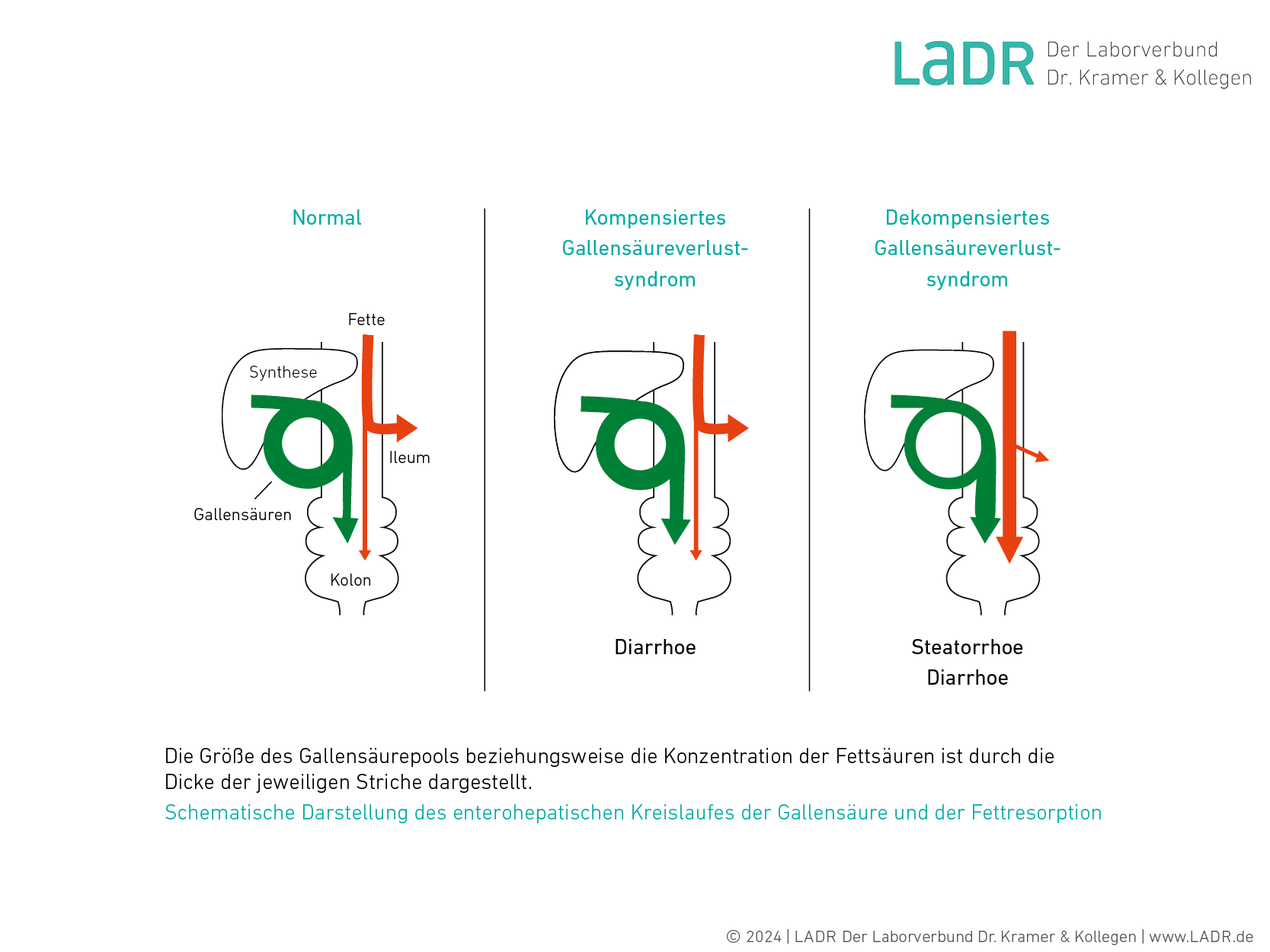
Gallensäuren (GS) sind nicht in der Nahrung enthalten und werden in der Leber aus Cholesterin synthetisiert. Nach Konjugation mit Glycin und Taurin werden unter physiologischen Bedingungen täglich 15–17 g GS in das Duodenum sezerniert. Die GS spielen eine wichtige Rolle bei der Resorption von Fettsäuren im Dünndarm durch Mizellenbildung, bei der Aktivierung von Pankreaslipase sowie bei der Resorption fettlöslicher Vitamine. Außerdem stabilisieren sie zusammen mit Lecithin das Cholesterin in der Galle.
Der größte Teil der primären Gallensäuren wird nach Dekonjugation aus dem terminalen Ileum rückresorbiert und gelangt über die Pfortader zur Leber. Ein geringer Teil wird durch Darmbakterien dekonjugiert und zu sekundären GS umgewandelt. Diese werden fast vollständig im Kolon resorbiert. Insgesamt gehen von den in das Duodenum sezernierten GS nur etwa 0,5 g/d mit dem Stuhl verloren. Der Verlust wird durch Synthese in der Leber ausgeglichen. Der überwiegende Teil der GS zirkuliert im enterohepatischen Kreislauf mehrfach täglich (sechs bis achtmal).
Bei Funktionsverlust des Ileums werden die GS weniger resorbiert und vermehrt mit dem Stuhl ausgeschieden. Die Ursachen für die GS-Malassimilation sind vielfältig: Resektion des terminalen Ileums, Morbus Crohn, Strahlenschäden,Gluteninduzierte Enteropathie. Auch unphysiologische Mengen der GS, die im Dickdarm dekonjugiert werden, können zur Diarrhoe führen. Der GS-Verlust kann durch gesteigerte Neusynthese in der Leber kompensiert werden. Kennzeichnend für ein solches kompensiertes GS-Verlustsyndrom sind sekretorische wässrige Durchfälle.
Übersteigt der GS-Verlust die Synthesekapazität der Leber, kommt es zum Zustand des dekompensierten GS-Verlustsyndroms. Solche Patient*innen entwickeln eine Diarrhoe und Steatorrhoe mit typischen Komplikationen wie Vitaminmangel, Osteomalazie, Oxalatnierensteine,Cholesteringallensteine u. a.
GS können im Stuhl quantitativ nachgewiesen werden. Die Differenzierung zwischen einem kompensierten und einem dekompensierten GS-Verlustsyndrom ist für das therapeutische Vorgehen von großer Bedeutung. Die Konzentration der Gallensäuren im Stuhl unterliegt starken intraindividuellen Schwankungen und sollte mehrfach bestimmt werden.

Zonulin im Stuhl
Zonulin (Prä-Haptoglobin 2) ist ein Glykoprotein, welches die Permeabilität der Tight Junktions (TJ) des Darmepithels reguliert und in den Epithelzellen gebildet wird. Die Tight Junktions bestehen aus Membranproteinen, die die benachbarten Epithelzellen miteinander verbinden und die parazelluläre Diffusionsbarriere bilden. Zonulin kann die Permeabilität der TJ für Makromoleküle wie Nahrungsmittelallergene oder mikrobielle Zellbestandteile erhöhen (Leaky Gut)mit inflammatorischen Reaktionen als Folge.
Erhöhte Zonulin-Konzentrationen können bei Patient*innen mit Autoimmunerkrankungen wie Zöliakie, Diabetes mellitus Typ I, rheumatoider Arthritis und Morbus Bechterew, bestimmten Erkrankungen des Nervensystems wie Multipler Sklerose und Schizophrenie oder entzündlichen Darmerkrankungen nachgewiesen werden.
Transglutaminase-IgA-Ak im Serum
Laut S2k-Leitlinie werden Stuhlteste im Rahmen der Zöliakie-Diagnostik nicht mehr empfohlen. Zur Primärdiagnostik einer Zöliakie werden ausschließlich Endomysium- bzw. Transglutaminase-IgA-Ak in Kombination mit einer Untersuchung des Gesamt-IgAs (alle Parameter aus Serum) empfohlen. Lediglich bei erniedrigtem Gesamt-IgAs sollten zusätzlich noch die IgG-Parameter abgeklärt werden.
PCR-Stuhldiagnostik bei akuter Gastroenteritis
Zum 1. Juli 2022 wurde kurzfristig die molekulare Diagnostik von Erregern akuter gastrointestinaler Infektionen in den EBM aufgenommen. Unter der Gebührenordnungsposition (GOP) 32853 wird der zeitgleiche Nukleinsäurenachweis eines oder mehrerer meldepflichtiger Erreger (Multiplex-PCR-Verfahren) erstattungsfähig und damit eine Leistung auch für gesetzlich Krankenversicherte. Ergänzend wurde die GOP unter der Ausnahmekennziffer 32006 aufgenommen, sodass die Anforderungen keine Auswirkungen auf Ihren Wirtschaftlichkeitsbonus haben.
-
Analysen
-
Downloads
-
Seminare
-
Konsiliarnetzwerk













































